
¿Qué es un ensayo clínico?
Es un estudio de investigación que sirve para evaluar la seguridad y la eficacia de un tratamiento, en el que participan personas. Dicho tratamiento ha sido previamente estudiado en un laboratorio (en cultivos celulares y en animales) con resultados satisfactorios.
¿Por qué son importantes los ensayos clínicos?
Los ensayos clínicos sirven para demostrar que un tratamiento en investigación es eficaz y seguro para las personas que lo usarán. La seguridad se evalúa recogiendo los efectos secundarios que surgen durante el estudio. La eficacia es la capacidad de una medicación para conseguir resultados beneficiosos. Además, es un requisito legal para la industria farmacéutica garantizar que los medicamentos disponibles hayan sido previamente probados en ensayos clínicos con resultados favorables. También proporcionan información valiosa para que los/las profesionales sanitarios puedan escoger los tratamientos más apropiados para sus pacientes.
¿Cómo se garantiza la seguridad de los voluntarios?
Los ensayos clínicos no se inician hasta que no haya suficientes garantías de que los medicamentos a investigar son seguros para los humanos. Previamente, los medicamentos en investigación han tenido que demostrar un mínimo de seguridad y eficacia en ensayos de laboratorio, lo cual es valorado por las autoridades sanitarias antes de empezar cualquier ensayo clínico en seres humanos. Para iniciar un ensayo clínico se requiere también autorización por parte de la agencia reguladora correspondiente, que en el caso de España es la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
¿Cuáles son las fases de la investigación clínica?
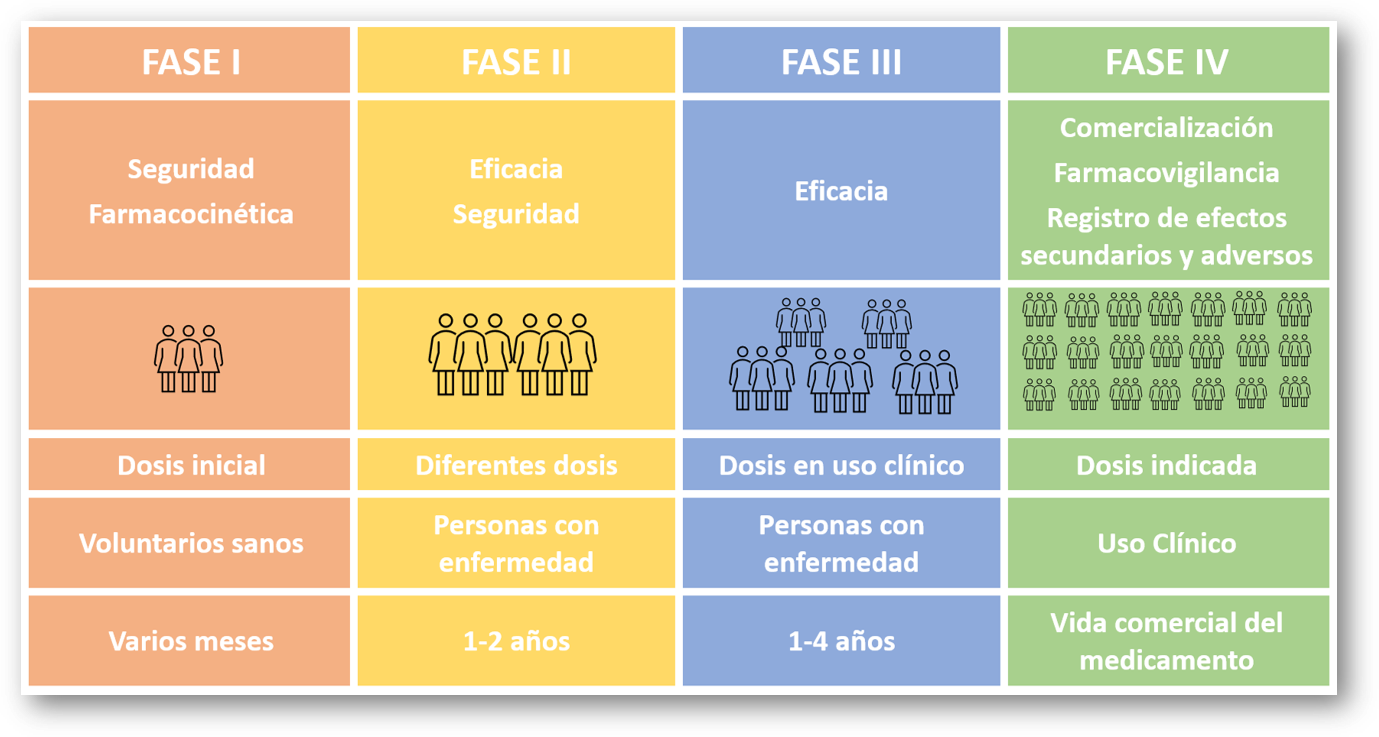
¿Cómo se tratan los datos confidenciales de los voluntarios?
La confidencialidad de los datos recogidos en los ensayos clínicos está regulada por la Agencia Española de Protección de Datos a través de la siguiente normativa:
- Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de carácter personal.
- Real Decreto 1720/2007, de 21 de diciembre, por el que se aprueba el Reglamento de desarrollo de la Ley Orgánica 15/1999.
- Ley 41/2002, de 14 de noviembre, reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
- Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos.
Garantizando así que los ensayos clínicos salvaguarden la integridad física y mental del sujeto, así como su intimidad y la protección de sus datos. Concretamente, el Artículo 7, apartado 3 de la Ley Orgánica de Protección de Datos, recoge que “Los datos de carácter personal que hagan referencia al origen racial, a la salud y a la vida sexual sólo podrán ser recabados, tratados y cedidos cuando, por razones de interés general, así lo disponga una Ley o el afectado consienta expresamente”.
¿Qué son los criterios de elegibilidad?
Los criterios de elegibilidad son los requisitos que una persona debe cumplir para ser incluida en un ensayo. Estos requisitos ayudan a garantizar que los/las participantes en un ensayo comparten ciertos factores específicos como la edad, el estado general de salud y el tratamiento previo. Cuando se cumplen los mismos criterios de elegibilidad, es menos probable que otros factores o el azar afecten al resultado del estudio.
¿Qué es un placebo y el efecto placebo?
Un placebo es una sustancia inactiva o sustancia que carece de actividad farmacológica. El placebo tiene el mismo aspecto y se administra de la misma forma que el medicamento que se está investigando.
Un placebo puede tener un efecto terapéutico cuando el paciente que lo ingiere cree que se trata de un medicamento con actividad farmacológica. Esta acción curativa o de mejoría resultante es lo que se denomina efecto placebo.
¿Qué es un control o grupo de control?
En un ensayo clínico, el grupo control es aquel que no recibe el nuevo tratamiento en estudio. Puede recibir placebo u otro tratamiento similar al que se está estudiando.
¿Qué es el consentimiento informado?
El consentimiento informado es un proceso por el cual un sujeto confirma voluntariamente su participación en un ensayo determinado, tras haber sido informado de todos los aspectos del ensayo que son relevantes para su decisión de participar. Los riegos de la participación en el ensayo son también descritos en este documento. El consentimiento informado se documenta mediante un formulario de consentimiento informado escrito, firmado y fechado. El objetivo del proceso de consentimiento informado es proteger a las personas que se inscriben en estudios clínicos.
¿Qué ocurre si decido no participar o cambiar de opinión una vez iniciado el ensayo?
La participación en la investigación clínica es completamente voluntaria. Por lo tanto, todos los participantes pueden abandonar un ensayo clínico en cualquier momento.
En el caso de que decida retirarse del ensayo, deberá comunicárselo al equipo de investigación, así como los motivos por los que abandona el estudio.
¿Puedo seguir tomando mi medicación habitual durante el ensayo?
Depende del ensayo. Deberá informar al equipo del estudio sobre todos los medicamentos que toma actualmente para que puedan decidir si existe algún riesgo potencial de interacción negativa o puede afectar a los resultados del estudio. Le indicarán si puede seguir tomando su medicación actual o si, por el contrario, el ensayo no es adecuado para usted.
¿Me pagarán por participar?
La remuneración varía en función del ensayo y del país. En general, no se paga a los pacientes por participar, pero pueden cubrirse los gastos. Sin embargo, hay ocasiones en las que se puede pagar por participar, sobre todo en los ensayos de fase I. El equipo de investigación explicará claramente cualquier compensación que se ofrezca durante el proceso de consentimiento informado.
¿Debería participar en un ensayo clínico?
Siempre es decisión del voluntario participar en un ensayo clínico, tras haber leído y comprendido un consentimiento informado. También se le realiza un seguimiento médico exhaustivo, para garantizar que su salud no está comprometida en ningún momento, mediante consultas con el médico especialista.
Al participar en un ensayo clínico, se promueve la colaboración en el desarrollo de nuevos tratamientos para las generaciones futuras. Por otro lado, el voluntario que participa en un ensayo clínico, en cualquier momento del puede abandonar el estudio si lo desea.
¿Quién está implicado en un ensayo clínico?
Voluntarios o pacientes: son la pieza central de un ensayo clínico, sin la cual el resto de los pacientes no podría tener acceso a los nuevos tratamientos aprobados en el futuro.
Comités Éticos: velan por la protección de los derechos, la seguridad y bienestar de los sujetos que participan en los ensayos clínicos.
Agencias Reguladoras: revisan y aprueban toda la documentación relacionada con un ensayo clínico, para conceder la autorización de comercialización del medicamento en un país o región.
Personal sanitario e investigador: llevan a cabo el ensayo clínico, evaluando la respuesta al medicamento.
Promotor: diseña y promueve el desarrollo del ensayo clínico y es el último responsable del estudio.
